セルソーター/セルアナライザーの技術情報/導入事例 – 痛みに関連するDRGニューロン細胞の細胞種類別ダメージフリーソーティング
【概要】 近年、痛みの可視化と痛みに関わる神経活動についての研究開発が様々な分野で行われている。感覚ニューロン(求心性ニューロン)の細胞体(DRGニューロン)は、外界や内臓からの痛みの情報に関わり、脊髄後根神経節(DRGs)に存在している事が知られている。しかし脊髄後根神経節の内部はさまざまな種類の細胞が存在し、いわゆるヘテロな細胞集団で構成されている。脊髄後根神経節内では、DRGニューロンの種類に依存して痛みに関わる分子に対する細胞応答性が異なる事が知られている。DRGニューロンを種類別に集めて、生化学的な評価や神経伝達に関する電気信号の評価が出来れば、定量的な評価系の1つとして痛みに関する薬剤開発などに有用なツールとなる。そこで我々は痛みに関するDRGニューロンをヘテロな細胞集団からOn-chip Sortを用いて目的細胞のソーティングを実施した。ソーティングは、使い捨てマイクロ流路を使い、シース液には培養液(Neural Basal Media)を使用した。ソーティング原理は、細胞にダメージを与えないFlow-shift法で行った。
DRGニューロンは古典的に大きさで分類されていた歴史を踏まえ、第一段階として大きさに基づいたソーティングを行い5日間培養を実施した。培養5日目に細胞を固定し、β-チューブリンIII(β-tublinIII)、シナプトフィジン(Synaptophysin)で染色し、分取した細胞がDRGニューロンであることを確認した。第二段階として、ペプチドニューロンと称されるisolectin B4(IB4)結合タンパク質を細胞表面に高発現しているDRGニューロンのみソーティングを実施した。ソーティングした細胞は全てIB4結合タンパク質高発現しているDRGニューロンである事を顕微鏡で確認した。さらにIB4結合タンパク質を高発現しているDRGニューロンを4日間培養した結果、神経突起の伸長が確認され、DRGニューロンにダメージがない事が確認された。
尚、本アプリケーションは東北工業大学 鈴木郁郎先生との共同研究による成果である。
【方法】 脊髄後根神経節(DRGs)の採取 脊髄後根神経節(DRGs)は、10週齢の成体ラット(Wister rats)から採取し、酵素処理により細胞を解離し培地(Neural Basal Media, 10%FBS, 1%NGF)で洗浄した後On-chip Sortによる細胞分離を実施した。
ソーティング On-chip Sortを用いて、大きさに基づく分取とIB4の発現に基づく分取をそれぞれ実施した。シース液には培養液を使用し目的細胞はOn-chip Sortに標準装備されているflow-shift法を用いた。ソーティングは2DchipZ1000S(On-chip biotechnologies Co., Ltd.)を用いた。
培養条件 ソーティングしたDRGニューロン細胞は、細胞培養用ディッシュに播種し、37°CのCO2インキュベーターで培養した。培養5日目に細胞をPFAで固定し、免疫染色(β-チューブリンIII、シナプトフィジン)により神経細胞である事を確認した。
【結果】
●On-chip Sortを用いた細胞の大きさに基づいたDRGニューロンのソーティング
ラットより採取した脊髄後根神経節(DRGs)から回収したヘテロな細胞集団をOn-chip Sortで解析した(Fig.1a)。解析により得られた細胞の大きさと複雑さを示すFSC-SSCのスキャッタプロットを、大きさの分布を把握する為にFSCのヒストグラムで展開した。 FSCによるサイズ分布から、4つの集団が確認された(Fig.1b) 。それぞれの集団にサンドイッチゲートをかけ、Large、Small、very small、red bloodとした。
はじめに、大きい細胞集団のサンドイッチゲート(Large)を選択し(Select population)、大きい細胞集団(Large population)のソーティングを実施した。ソーティング後の細胞は、ソーティング回収リザーバから回収し、細胞培養用のディッシュに播種した。
次に同じゲートを使用してサイズの小さい集団(Small)のサンドイッチゲートを選択し(「Select population」)ソーティングを行った(Fig.1c)。
サイズの大きい集団と、サイズの小さい集団はそれぞれ培養ディッシュに撒きCO2インキュベータで5日間培養した。
●細胞の大きさに基づいて採取したDRGニューロンの免疫染色
脊髄後根神経節(DRGs)内の細胞を、大きさ情報(FSC)を元にOn-chip Sortで採取した細胞群(大きい細胞群と小さい細胞群)を5日間培養した後、パラフォルムアルデヒドで固定し、免疫染色を行った。その結果、大きい細胞群(Fig.2a)も、小さい細胞群(Fig.2b)も神経細胞の微小管タンパクであるβ‐チューブリンIII(β-tublin III)と、神経伝達に関与するニューロンが発現するシナプトフィジン(Synaptophysisn)の発現が確認された。この結果から、DRGニューロンを細胞のサイズ別にダメージフリーでソーティングし、培養出来る事が明らかになった。
●イソレクチンB4(isolectin B4, IB4)ポジティブのDRGニューロンのソーティング
DRGニューロンは、ペプチド作動性ニューロンと非ペプチド作動性ニューロンの存在が知られており、その違いは、イソレクチンB4(isolectin B4, IB4)の結合で分類され、 IB4は、非ペプチド作動性ニューロンに結合する事が報告されている(Ref.1,2)。そこで我々は、IB4-Alexa546でDRGニューロンを含む脊髄後根神経節(DRGs)の細胞集団の染色を行い染色後の細胞を顕微鏡観察した(Fig.3a)。次にIB4で染色したDRGs細胞群をOn-chip Sortで解析した。その結果、細胞表面のIB4結合タンパク質の発現量が多い集団(IB4-high)と発現量がやや弱い集団(IB4-mid)が存在している事が解った(Fig.3b)。そこで、我々は「IB4-high」の集団(全体の0.15%)を選択し(Select population)On-chip Sortを用いて細胞表面のIB4結合タンパク質が多く発現しているDRGニューロンのソーティングを実施した。本実験で得られた細胞表面のIB4結合タンパク質の発現量の差異を細胞の大きさと複雑さを示すFSC-SSCで展開し、大きさや複雑さに差異があるか否か確認した。細胞表面のIB4結合タンパク質の発現量とFSC-SSC(細胞の大きさと複雑さ)には関係が無い事が解った(Fig.3c)。
●ソーティング後の細胞表面IB4結合タンパク質が高発現しているDRGニューロンの顕微鏡観察とソーティングした細胞のDRGニューロンの培養
ソーティングしたIB4-highの集団をソーティングした後に顕微鏡観察を行った。その結果、IB4-highの集団だけがソーティングされている事が確認出来た(Fig.4a)。ソーティングしたIB4-highの細胞を4日間CO2インキュベーターで培養し、顕微鏡観察を行った。
その結果、神経突起の伸長が観察された(Fig.4b)。この結果からIB4結合タンパク質を高発現しているDRGニューロン細胞にダメージを与えることなくソーティングし培養出来る事が明らかになった。
【まとめ】 On-chip Sortを用いて痛みに関係するDRGニューロンを脊髄後根神経節(DRGs)のヘテロな細胞集団から培養液(Neural Basal Media, 10%FBS, 1%NGF)をシース液として使用し、flow-shift法を用いて大きさ情報を基に無染色で細胞にダメージを与えることなくソーティングする事が可能であった。ソーティングした細胞は、神経細胞の微小管タンパクであるβ‐チューブリンIII(β-tublin III)と、神経伝達に関与するニューロンが発現するシナプトフィジン(Synaptophysisn)の発現が確認されニューロンであることも確認された。またイソレクチンB4(IB4)-Alexa546を用いた細胞染色によりIB4結合タンパク質を細胞表面に高発現している細胞だけを選択的にソーティングする事が可能であり、IB4高発現の細胞群の神経突起の伸長が確認された。この結果からダメージなく表現型が同じDRGニューロンをダメージフリーでソーティング出来ることが確認された。
本技術を用いて表現型を揃えたDRGニューロンを分取し、その細胞を用いた痛みに関する薬剤開発などへの生化学的な評価や神経伝達に関する電気信号への定量的な評価への応用に有用なツールの1つと可能性が示唆された。
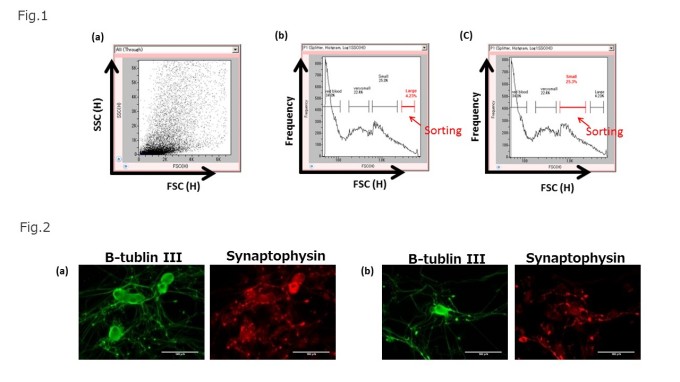
Fig.1 DRGs内の細胞集団をOn-chip Sortで測定したFSC-SSCドットプロットと大きさ(FSC)のヒストグラムとソーティングゲート(サンドイッチゲート)脊髄後根神経節(DRGs)内のヘテロな細胞集団全体のFSC(H)とSSC(H)のスキャッタプロット(a)。FSC(H)をヒストグラムで展開し、大きさの大きい分画をサンドイッチゲートを掛けた。ソーティングを実施したい大きいサンドイッチゲートを選択し、「Select population」を選択し、ソーティングを実施した(b)。ソーティングをしたい集団のゲートを選択し「Select population」でソーティングした。
Fig.2 脊髄後根神経節(DRGs)内のニューロン細胞の確認。 On-chip Sortを用いてソートした大きい細胞群(a)と小さい細胞群(b)をβ‐チューブリンIII(β-tublin III、緑色)、シナプトフィジン(Synaptophysisn、赤色)でそれぞれ染色し、大きい細胞群、小さい細胞群、それぞれ、神経細胞が存在する事が確認された。
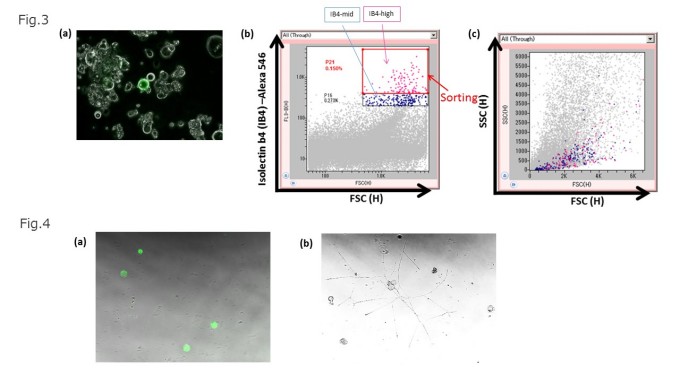
Fig.3 脊髄後根神経節(DRGs)中の細胞群をイソレクチンB4(isolectin B4, IB4)-Alexa546で染色後、顕微鏡観察とOn-chip Sortによる解析。DRGs細胞群をIB4-Alexa546で30分染色し、培地で洗浄した後に蛍光顕微鏡での観察した(a)。 図(a)中の中央に緑で確認される細胞だけがIB4-positiveであった。IB4-Alexa546で染色したDRGsをOn-chip Sortで解析をした。その結果、細胞表面のIB4結合タンパク質の発現量が高い集団(IB4-high;0.15%)、と少し弱い集団(IB4-mid;0.273%)とが存在し、IB4結合タンパク質の細胞表面の発現量に差異がある事が確認された(b)。 IB4-highの集団を選択し、ソーティングを実施した。IB4の発現量の差異をFSC-SSCで展開しなおし細胞の大きさとIB4の発現量には関係性が無い事を確認した(c)。
Fig.4 細胞表面にIB4結合タンパク質が高発現しているDRGニューロン細胞のソーティング直後の顕微鏡観察と培養4日目の顕微鏡観察。 On-chip Sortを用いてソートしたIB4高発現しているDRGニューロンのみをソーティングした後、培養ディッシュに播種した直後に蛍光顕微鏡観察を実施した(a)。(a)の細胞を培養4日目に顕微鏡観察を行い、神経突起の伸長を確認した(b)。Bar=20um。
References
1) Cheryl L. Stucky and Gray R. Lewin.(1999)
Isolectin B4-Positive and –Negative Nociceptors Are Functionally Distinct. The Journal of Neuroscience. 19(15):6479-6505
2) Neva J Fudge and Karen M Mearow.(2013)
Extracellular matrix-associated gene expression in adult sensory neuron populations cultured on a laminin substrate. BMC Neuroscience, 14:15.