ダメージフリーソーティング
近年、セルソーティングによる細胞の形態変化、細胞増殖の遅延、細胞生存率の低下、および遺伝子発現の変化などが認知されるようになった。 これらソーティング後の細胞変化は、Jet-in-air法と呼ばれる既存のソーティング技術によって引き起こされる「Sorter-Induced Cellular Stress (SICS、ソーター誘発性細胞ストレス)」の結果であり、SICSを起こしやすい細胞を含むソーティングは極めて困難である。
On-chip Sortは多種多様な細胞タイプ、特に神経細胞、iPS由来細胞、遺伝子導入後の細胞、心筋細胞、肝細胞、精子、脂肪細胞などの一般のソーティングには適さない細胞に使用されている。 ここでは、共同研究を通して得られた結果を説明する。
細胞増殖に及ぼすソーティングの影響
増殖能力の高いHeLa細胞におけるソーティングの効果を従来のセルソーター(ジェットインエアー法)とOn-chip Sort(フローシフト法)間で比較するため、約100個のHeLa細胞を両方のソーターでソーティングした。 ソーティング後、収集した細胞を96ウェルプレートのウェル中で培養し、細胞数を計数した。
 図1.ソーティング後のHeLa細胞の増殖曲線。 画像は3日目に撮影。
図1.ソーティング後のHeLa細胞の増殖曲線。 画像は3日目に撮影。
On-chip Sortによってソーティングされた細胞は、ソーティングから2日後に増殖を始め、細胞数は3日目に2倍になった(図1)。 一方、従来のソーターでソーティングされた細胞は、ソーティング後3日目に増殖を始め、On-Chip Sortでソーティングされた細胞と比較して増殖速度が遅かった(図1)。
細胞形態に及ぼすソーティングの影響
物理的損傷を受けやすい好酸球の形態を、従来のソーターとOn-chip Sortでソーティングして比較をした。
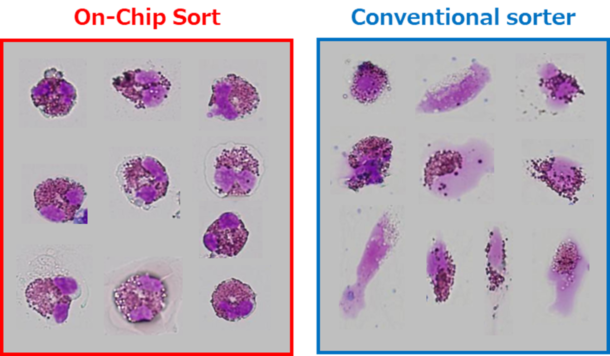 図2. ヘマトキシリンとエオシンで染色し、On-chip Sort(左)と従来のソーター(右)でソーティングした後にサイトスピンで固定した末梢血好酸球の形態。
図2. ヘマトキシリンとエオシンで染色し、On-chip Sort(左)と従来のソーター(右)でソーティングした後にサイトスピンで固定した末梢血好酸球の形態。
図2は、ヘマトキシリンおよびエオシンで染色し、On-chip Sort(左)および従来のソーター(右)によるソーティング後にサイトスピンによって固定された末梢血由来の好酸球の形態を示しているが、ソーティング後の形態学的差異が明らかに観察された。 On-chip Sortによってソーティングされた好酸球は、細胞構造を維持したままの細胞がほとんどであった。 しかし、従来のソーターでソーティングされたものは破裂したものが多く確認された。 従来のソーターによるソーティングが細胞膜に損傷を与えたと推測される。
RNA発現に及ぼすソーティングの影響
遺伝子発現解析を行う前段階として細胞をソーティングするニーズがあるが、SICSによる細胞ダメージがどの程度RNA発現に影響を与えるかはいまだによく知られていない。ソーティングによるOn-chip Sortと従来のソーターの遺伝子発現パターンに差が生じるかを調べるため、50,000個のCaco-2およびHeLa細胞を双方のソーターでソーティングした。 各細胞種の遺伝子発現レベルの変化は、対照としてソーティングしていない細胞を用いてマイクロアレイ解析結果を使用した。

図3. (a) On-chip Sortおよび (b) 従来のソーターAにおけるHeLa細胞の遺伝子発現レベル変化の比較。赤い点は上方制御、緑色の点は下方制御された遺伝子を表している。数値は全データに対する割合。(c) Coca-2とHeLa細胞においてソーティング後に発現レベルに変動がなかった遺伝子の割合を示すヒストグラム。数値は、各プロパティ(apoptosis、cell adhesion、cell cycleなど)で分類した全遺伝子に対する影響を受けていない遺伝子の割合。 発現変化比は、ソーティングした細胞のシグナル強度/未ソーティング細胞のシグナル強度で算出。マイクロアレイ解析協力:株式会社セルイノベーター受託研究部 安田様、萩原様;九州大学 田代康介先生
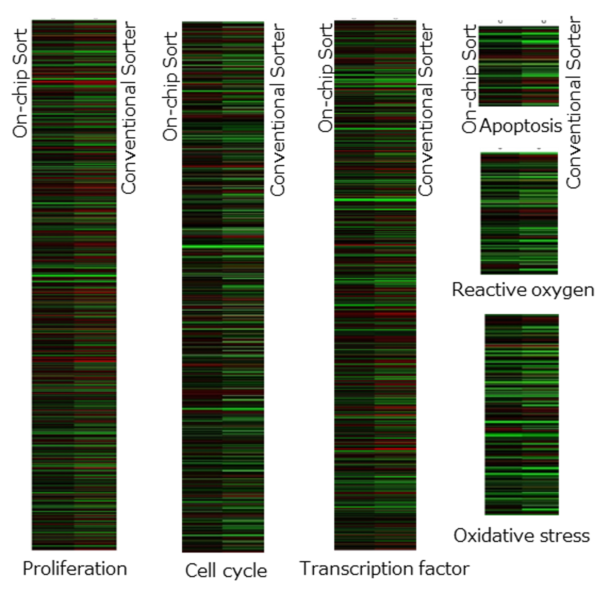
図4. 分類した中で主に差が認められたプロパティの遺伝子発現解析パターン。左側の列はOn-chip Sortのデータを表し、右側の列は従来のソーターのデータを表す。 黒は遺伝子発現に変化がないことを示し、赤は上方制御、緑は下方制御を示している。マイクロアレイ解析協力:株式会社セルイノベーター受託研究部 安田様、萩原様;九州大学 田代康介先生
図3AおよびBは、On-chip SortによりソーティングしたHeLa細胞が、従来のソーターによってソーティングされたものよりも遺伝子発現における変化が少ないことを示している。さらに、遺伝子発現レベルに変化のない遺伝子の数は、従来のセルソーターよりOn-chip Sortによるソーティングの後で3〜5倍高かった(図3C)。図4は、異なるプロパティの遺伝子発現パターンを示している。増殖、細胞周期、転写因子、アポトーシス、活性酸素および酸化ストレスの分類において、ソーター間に明らかな違いが確認できる。この遺伝子発現パターンの違いは、図1で見られたソーター間の増殖速度の違いを裏付けている。この結果はソーティング後30~60分の間に次処理をした結果であるため、手技的な工夫次第では今回示した結果と異なる結果が得られる可能性はあるが、On-chip Sortと従来のソーターでソーティング後の遺伝子発現における差異を確認することができた。
ソーティングによる影響を受けやすい細胞
ニューロン
近年、痛みの可視化と痛みに関わる神経活動についての研究開発が様々な分野で行われている。感覚ニューロン(求心性ニューロン)の細胞体(DRGニューロン)は、外界や内臓からの痛みの情報に関与し、脊髄後根神経節(DRGs)に存在している事が知られている。しかし脊髄後根神経節の内部はさまざまな種類の細胞が存在し、いわゆるヘテロな細胞集団で構成されている。脊髄後根神経節内では、DRGニューロンの種類に依存して痛みに関わる分子に対する細胞応答性が異なる事が知られている。DRGニューロンを種類別に集めて、生化学的な評価や神経伝達に関する電気信号の評価が出来れば、定量的な評価系の1つとして痛みに関する薬剤開発などに有用なツールとなる。そこで我々は痛みに関するDRGニューロンをヘテロな細胞集団からOn-chip Sortを用いて目的細胞のソーティングを実施した。
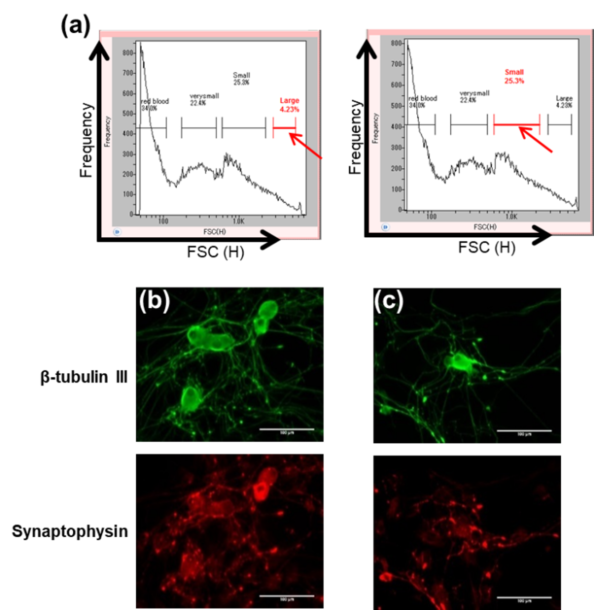
図5. (a) 脊髄後根神経節(DRGs)内のヘテロな細胞集団全体のFSC(H)とSSC(H)のスキャッタプロット。サイズ別にDRGサンプルからソーティングした二つの集団(”Large”と”Small”、赤い矢印)をβ‐チューブリンIII(β-tublin III、緑色)、シナプトフィジン(Synaptophysisn、赤色)でそれぞれ染色し、(b)大きい細胞群、(c)小さい細胞群、それぞれ、神経細胞が存在する事が確認した。共同研究:東北工業大学 鈴木郁郎先生
脊髄後根神経節(DRGs)は、10週齢の成体ラット(Wister rats)から採取し、酵素処理により細胞を解離し培地(Neural Basal Media, 10% FBS, 1% NGF)懸濁した。 前処理したサンプルをサイズによってソーティングした(図5)。 サイズ分布から4つの細胞群が確認され、そのうち二つを別々にソーティングした後、5日間培養した。 両集団をパラホルムアルデヒドで固定し、神経細胞に見られる微小管タンパク質をβ-チューブリンIII、神経伝達を担う神経細胞を抗シナプトフィジンで染色した。 結果、両方の集団がDRGにおける生存神経細胞であることが確認された。 したがって、On-chip Sortが生存率を維持しながらサイズによってDRGニューロンを単離することができることを証明した。
iPS細胞
再生医療の分野では胚性幹細胞やiPS細胞から分化させた細胞を患者に移植しようとする研究が増えてきているが、分化せず未分化のままの細胞は体内で腫瘍性となる可能性が高く、患者治療の進歩を妨げる可能性があるため移植前に未分化細胞を効率的に除去する必要性があると考えられている。 On-chip Sortは、「繰り返しネガティブソーティング」と呼ばれる方法によって、サンプル中に存在する微量な未分化細胞を効果的かつ効率的に除去することができる。
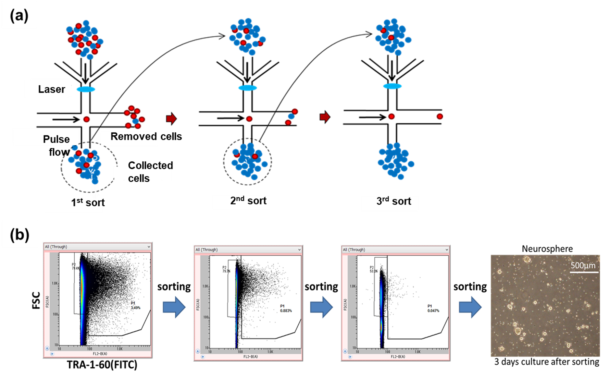
図 6. (a) 繰り返しネガティブソーティングの原理(赤い点は未分化細胞、青い点は分化細胞)。 (b) 繰り返しネガティブソーティングによる分化した神経幹細胞のサンプルからの未分化細胞の除去。共同研究:京都大学 中馬新一郎先生
On-chip Sortによる繰り返しネガティブソーティングは、分化した細胞と少数の未分化細胞が混在したサンプルから「不必要なもの(=未分化細胞)を分取する」ことで成り立つ。未分化細胞(非標的細胞)は回収リザーバーへのパルス流の形成によって除去され、分化細胞(標的細胞)はチップの下流に位置する廃棄物リザーバーへと流れる。 分化した細胞を廃液リザーバーから回収し、さらなる純化のために再度ソーティングを行い、 全ての未分化細胞が除去されるまでこの過程を繰り返す(図6a)。図6bは、神経幹細胞に分化した細胞の中に約4%で存在する未分化細胞の除去のプロセスを表している。未分化細胞をFITC標識抗TRA-1-60抗体で染色し、蛍光シグナルを検出した。未分化細胞は三回のネガティブソーティング後にすべて除去されたことを確認した。また、回収した分化細胞も培養し、それらが培養可能であることを確認した(図6b)。
細胞複合体
On-chip Sortは、通常のピペッティングによって容易に解離してしまうような細胞間の弱い結合も保持したままソーティングができる。 図7は、三種の細胞からなるサンプルからこのような細胞間相互作用によって形成された細胞ダブレット(緑色細胞および赤色細胞)の単離が可能であることを示している。
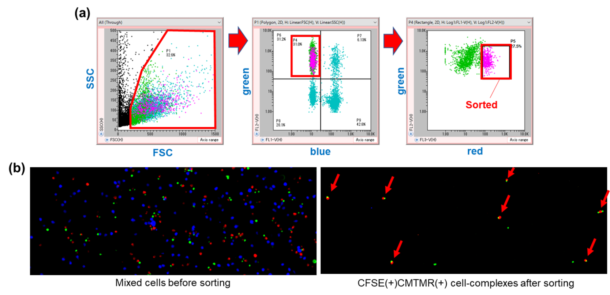
図7. (a) ダブレットソーティングのためのゲート展開図。(b) On-chip Sortによるソーティング前(左)とソーティング後(右)の蛍光顕微鏡写真。