ドロップレットとは、マイクロメートルスケールの微小な水滴を指し、内部に微生物や細胞などを封入することができます。ドロップレットは短時間で大量作製できることから、多種多様なサンプルを同時並行的に解析することが可能です。これらの特徴から、ドロップレットは解析速度の向上、小スケール培養、シングルセル解析などの利点があり、ハイスループットスクリーニング(HTS)などを含めた様々な領域にて利用されています。
ドロップレット技術の優位性
- 各ドロップレットがマイクロプレートの1ウェルとして機能
- 100万を超える反応場(ドロップレット)が1チューブに格納できる
- 解析時間/試薬量/実験工程の効率化
- On-chip Sort、 On-chip Droplet Selectorにより目的ドロップレットを分離可能
| ウェルプレート(従来法) | ドロップレット(次世代法) | |
|---|---|---|
| 1反応系あたりの液量 | 100μL/1well | 100pL ~ 1 drop |
| 100万サンプルの解析に必要なもの | 384wellプレート x 2,600枚 | 1チューブ |
| 解析時間 | 数日 | 数時間 |
| コスト | 高い | 低い |
アプリケーション
油中水滴型 (Water-in-Oil) ドロップレット
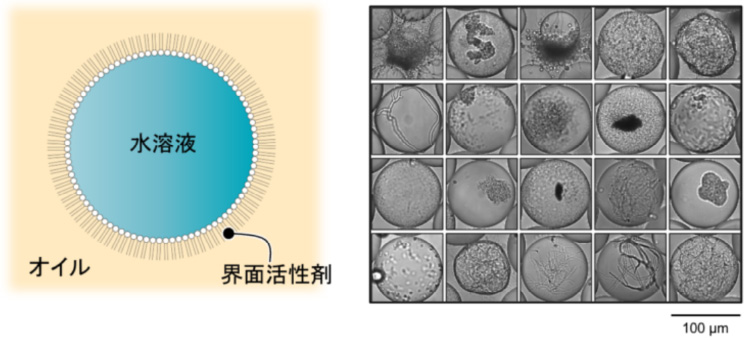
- ・構造:
- 水滴(培地など)がオイル中に分散し、界面活性剤により安定化したエマルション
- ・特徴:
- オイルで隔てられているため、各ドロップレットで微生物/細胞が増殖し、代謝物が蓄積されていく。
ドロップレット作製時に基質を加えることで培養に伴う代謝物を検出可能 - ・用途:
- 微生物培養、環境微生物/変異株スクリーニング、酵素の指向性進化 など
シングルセル培養
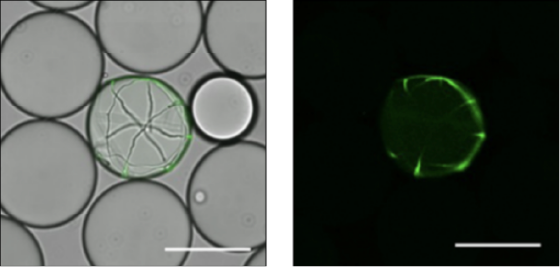
1細胞レベルからの培養により、各細胞/菌体の増殖やタンパク質発現、分泌量に基づくスクリーニングが可能に
Luu, X. C., Shida, Y., Suzuki, Y., Sato, N., Nakamura, A., Ogasawara, W.. New Biotechnology 2022 72, 149-158.
新規微生物探索

土壌、水圏、極限環境などあらゆる環境に多様に存在する微生物から新たな微生物を単離するためのツールとして
Nakamura, A., Honma, N., Tanaka, Y., Suzuki, Y., Shida, Y., Tsuda, Y., Hidaka, K., Ogasawara, W., Analytical Chemistry 2022 94 (5), 2416-2424.
異種菌体相互作用
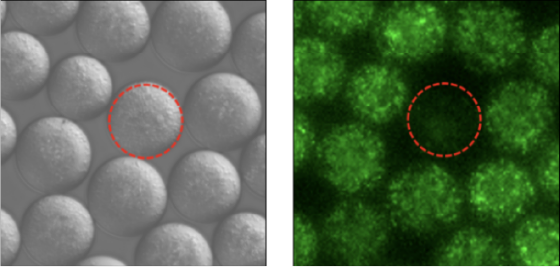
ドロップレットのハイスループット性を生かして、様々な種類の菌の組み合わせが封入されたライブラリーを簡単に作製
理化学研究所 バイオリソース研究センター 市橋泰範 先生, 成川 恵 先生よりデータ提供
ゲルマイクロドロップ (GMD)
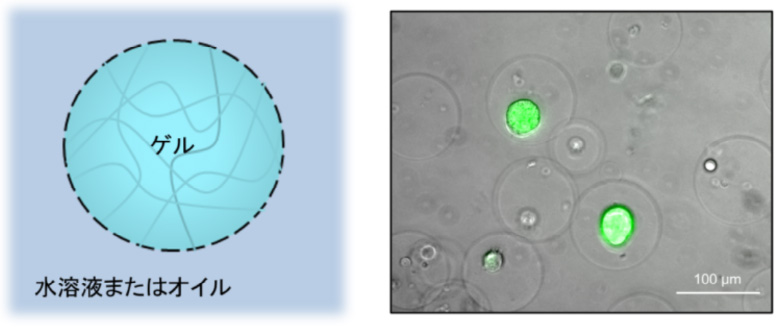
- ・構造:
- 内部がゲル化したドロップレット
- ・特徴:
- オイルではなく、培地等に分散することができるため、ドロップレット内外における物質の透過性が高い。
一方で、ゲルを足場として細胞やビーズ、ゲノムなどの比較的大きい物質は保持される。 - ・用途:
- 細胞培養、変異株/抗体産生細胞スクリーニング、微生物間相互作用研究 など
タンパク質高生産株の単離
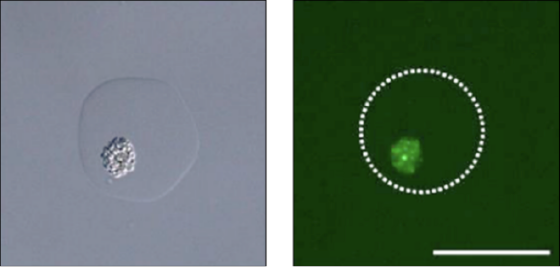
UV変異株ライブラリーなどの大量検体中から高活性/高生産株を高速に取得
Fujitani, H., Tsuda, S., Ishii, T., Machida, M., bioRxiv 2019
物質生産量に基づくスクリーニング
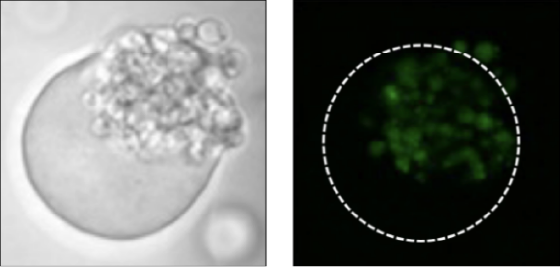
GMD培養後に菌体内を染色することで、物質生産量に基づくスクリーニングが可能
Tanaka, Y., Nakamura, A., Suzuki, Y., Maruta, K., Shida, Y., Ogasawara, W. , Journal of Biotechnology 2022 358, 46-54.
腸内細菌叢の機能解明
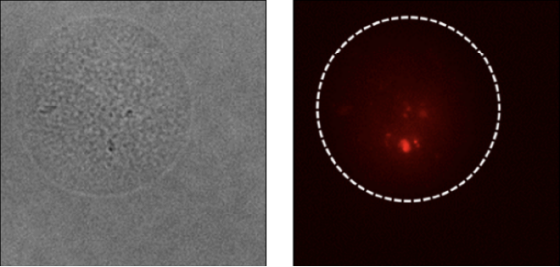
多様な腸内細菌叢の機能解明に向けたハイスループットスクリーニング
慶應義塾大学 先端生命科学研究所 福田真嗣 先生よりデータ提供
ドロップレットの分取
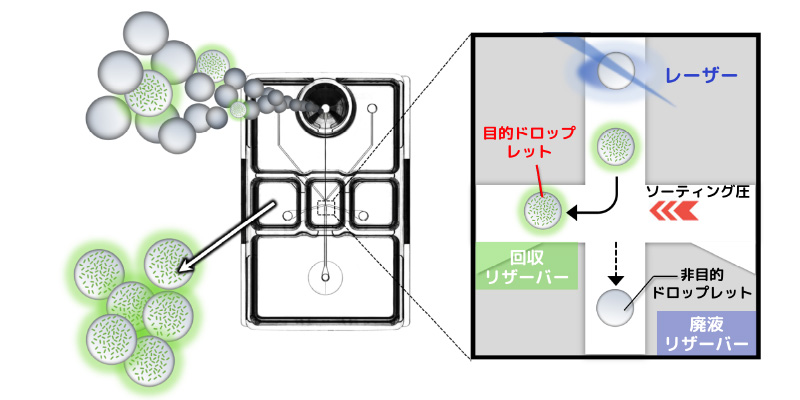
On-chip Sort / On-chip Droplet Selectorのマイクロ流路チップ技術を用いることで酵素反応 / 増殖活性 / 抗体反応などを指標に目的のドロップレットを壊さずに分取することができます。

微生物が増殖したドロップレットの検出と分取
産業技術総合研究所の野田先生らのチームでは、微生物が増殖したドロップレットを蛍光で検出する手法としてFNAP-sort (Fluorescent nucleic acid probe in droplets for bacterial sorting) を考案しました。本手法は、FRET(Fluorescence resonance energy transfer)により消光状態の蛍光核酸プローブが微生物の増殖に伴って生じるRNaseによって切断されることで、FRETが解消されて蛍光するという原理です。
本プローブは弊社からも販売しております(品番 : 2004001, 2004002)。
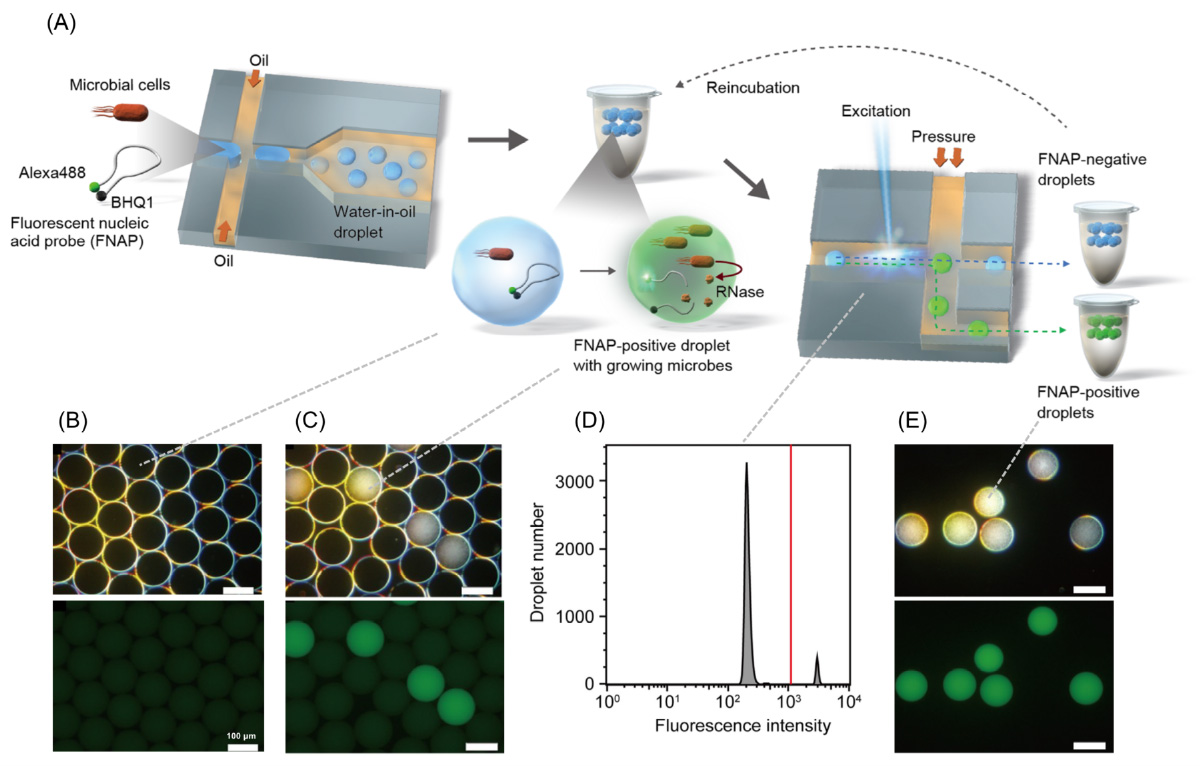
FNAP-sortワークフローと原理実証
(A) FNAP-sortワークフロー (B) 作製直後のドロップレットの顕微鏡写真 (C) 1日培養後のドロップレットの顕微鏡写真 (D) 培養1日後のドロップレットの蛍光ヒストグラム (E) ソーティングドロップレットの顕微鏡写真 (B), (C), (E)について上図は暗視野、下図は蛍光視野
Ota, Y., Saito, K., Takagi, T., Matsukura, S., Morita, M., Tsuneda, S., Noda, N., PLOS One 2019 14(4), e0214533.
Saito, K., Ota, Y., Tourlousse, D. M., Matsukura, S., Fujitani, H., Morita, M., Tsuneda, S., Noda, N., Scientific Report 2021 11(1), 9506.
解析サンプル一覧
細胞を封⼊したW/Oドロップレット・GMDのソーティング
| 微生物 | ⼤腸菌 |
|---|---|
| 菌根菌 | |
| 枯草菌 | |
| 放線菌 | |
| 麹菌 | |
| カビ | |
| 酵⺟ | |
| オイル産⽣藻類 | |
| テトラヒメナ |
| 環境サンプル | ⼟壌細菌 |
|---|---|
| 海⽔・湖⽔中微⽣物 | |
| 腸内細菌 | |
| マイクロプランクトン | |
| スクリーニング (HTS) | CHO細胞 |
| ハイブリドーマ | |
| 無細胞翻訳系 | |
| GPCR反応系 | |
| 遺伝⼦ | デジタルPCR |
| ⾮⽣物 | ビーズ |
|---|---|
| PEG | |
| ゼラチン | |
| 低融点アガロース | |
| アルギン酸 | |
| コラーゲン |
その他